| 플라스틱 분해와 업사이클링 기술 최신 연구 동향 | |
|---|---|
| Date 2024-04-30 13:18:48 |
|

선임연구원 / 박사 후 연구원 / 박사과정
한국과학기술연구원 청정에너지연구센터
ajungho@kist.re.kr / dowookkim@kist.re.kr / gahyun24@kist.re.kr
1. 서론
현재 우리 생활과 플라스틱은 그야말로 떼려야 뗄 수 없는 사이이다. 플라스틱의 이용량은 매년 시간이 흐를수록 더욱더 증가하여 2050년 전 세계 플라스틱 생산량은 300억 톤을 넘을 것으로 예상된다 [1]. 이렇게까지 플라스틱이 사용되는 이유는 특유의 내구성, 경량성, 안정성 등 많은 기존 재료를 대체하기 용이하며 경제적이기 때문이다. 하지만 플라스틱이 우리에게 준 편의는 사용 후의 플라스틱 폐기물을 어떻게 처리해야 할 것인가에 대한 문제를 필수 불가결하게 불러온다. 안정적인 플라스틱의 특성상 자연적으로 분해가 거의 이루어지지 않기 때문에 대부분의 플라스틱 폐기물은 매립하거나 소각되고 있다 [2]. 하지만 이러한 처리법은 환경 문제를 대두시켰고, 쌓여가는 폐기물 문제를 해결하기 위해 여러 가지 재활용 방법이 개발되고 있다 [3].
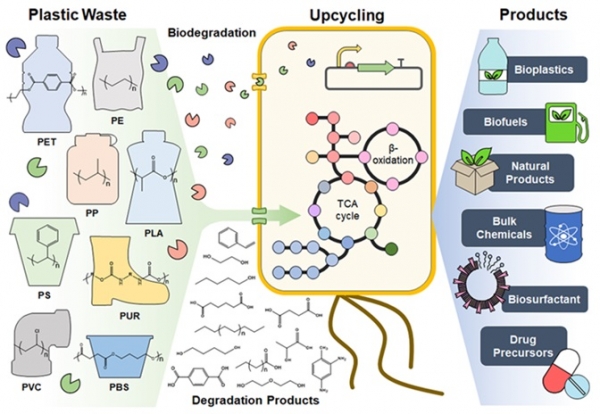
우리에게 가장 친숙한 플라스틱의 재활용은 기계적 재활용이다. 이는 플라스틱을 분쇄하고 용융시켜 새로운 제품을 만드는 방법으로 비교적 간단하지만, 분리와 세척 등의 과정이 필요하며 플라스틱의 질적 요건이 떨어질 수 있다 [4]. 다음으로 화학적 재활용의 경우 가스화, 열분해, 해중합과 같은 공정으로 올리고머, 단량체, 기체 생성물을 얻어 다시 화학 공정의 원료로 사용할 수 있으나, 고에너지를 요구하고 온실가스와 독성 잔류물을 생성할 수 있다 [5]. 앞서 언급한 두 방법의 단점은 미생물을 이용한 생물학적 재활용을 통해 보완 가능하다. 물론 현재, 플라스틱을 분해할 수 있는 효소와 미생물의 보고가 많지 않고 그에 따라 효율성 역시 상대적으로 낮지만, 지속해서 발전된 대사 능력과 에너지 절약적인 분해 환경, 분해 후 즉각적인 바이오 업사이클링 프로세스 적용이 가능하다는 점을 종합적으로 고려하였을 때, 생물학적 재활용은 지속 가능한 플라스틱 경제를 이끌어가기 위해 바람직하다. 본 기고문에서는 플라스틱의 분해에 쓰이는 생물학적 기법들과 플라스틱의 분해 산물을 이용한 고부가가치 산물 생산 연구를 소개하고자 한다(그림 1).
그림 1. 플라스틱 폐기물의 생분해 및 바이오 업사이클링.
2. 본론
폴리에틸렌 테레프탈레이트(PET)
자연의 놀라운 적응과 진화의 산물로, 각각의 플라스틱을 분해하는 여러 종의 미생물이 발견되었고 이러한 미생물이 만들어 낸 특별한 효소들이 발굴되었다(그림 2). 2016년 일본의 PET 재활용 공장에서 발견된 Ideonella sakaiensis 이외에도, Thermobifida fusca, Fusarium solani pisi 등의 미생물에서 발견된 PET를 분해하는 효소인 PETase는 PET 분해 연구에 큰 진전을 가져다주었다 [6]. PETase의 발견 이후로 PET를 분해하는 효소를 발굴하기 위한 여러 연구들이 이어졌다. 산업계에서도 활발한 연구가 이어졌으며, 카바이오스(Carbios)에서는 2020년 나뭇잎 퇴비에서 발견한 leaf-branch compost cutinase (LCC)를 개량한 변종 효소 LCC-ICCG를 개발하여 PET병 원재료를 10 시간 만에 90% 분해한다고 발표하였다 [7].
PET는 에틸렌글리콜(EG)과 테레프탈산(TPA)이 중합된 고분자로, 앞서 소개한 PETase, LCC 등의 PET 분해 효소가 PET 내에서 상대적으로 약한 에스터 결합을 가수분해하여 bis(2-hydroxyethyl) terephthalic acid (BHET), mono(2-hydroxyethyl)terephthalic acid (MHET), TPA, EG 등의 소분자를 생산한다. PET 고분자뿐만이 아니라 MHET와 BHET를 TPA와 EG로 완전히 분해하는 MHETase, BHETase 역시 Bacillus subtilis sp. PET-86, Chryseobacterium sp. PET-29 등의 미생물에서 발견됨에 따라 PET의 완전한 미생물 기반 분해가 가능해졌다 [8]. 이에 발맞추어 미생물 균주를 이용하여 PET 분해 산물을 원료로 고부가가치 산물을 생산하려는 시도들이 더욱 각광을 받고 있다.
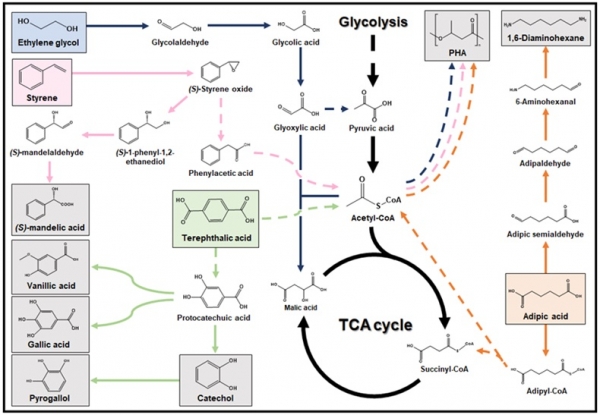
최근 Pseudomonas putida KT2440를 활용하여 플라스틱 분해 산물로 다시 플라스틱을 재합성하는 연구가 진행되었다 [9]. 이 균주는 EG를 원료로 생분해성 플라스틱인 polyhydroxyalkanoic acid (PHA)를 성공적으로 생산하였다. EG는 일반적인 미생물이 사용할 수 없는 탄소원이나, EG를 미생물이 사용할 수 있도록 전환하기 위하여 glyoxylate carboligase, hydroxypyruvate isomerase, tartronate semi-aldehyde reductase, hydroxypyruvate reductase, pyruvate kinase를 포함하는 대사 경로의 도입이 이루어졌으며 이를 통해 미생물은 EG를 acetyl-CoA로 변환시켜 생장할 수 있었다. 추가로 PHA를 생산하기 위해 glycolate oxidase를 과발현하여 독성을 가지는 중간 물질 glycolaldehyde와 glycolic acid의 축적을 방지하고 P. putida KT2440 균주에 내재한 PHA 생산 경로를 강화하였는데, 이를 통해 acetyl-CoA가 세포 생장과 더불어 목표 물질 생산에도 쓰일 수 있음을 검증하였다.
PET의 또 다른 분해 산물은 TPA이다. 고리형 구조는 포도당과 같은 일반적인 탄소원으로부터 생산하는 것이 까다롭기 때문에, 벤젠 고리를 보유한 TPA를 탄소원으로 사용함으로써 protocatechuic acid (PCA)와 같은 고부가가치 고리형 물질의 생산 전략을 새롭게 설계할 수 있다. 최근 TPA를 유일한 탄소원으로 생장하는 Comamonas sp. E6 균주에서 TPA 1,2-dioxygenase와 1,2-dihydroxy-3,5-cyclohexadiene-1,4-dicarboxylate dehydrogenase 효소가 새로 발견되었으며 [10] 이 효소들을 Escherichia coli에 도입하여 TPA를 원재료로 PCA를 생산하였다(그림3). 이렇게 제작된 PCA 생산 E. coli 균주에 추가적인 대사 경로를 도입하면 PCA를 전구체로 하는 gallic acid, pyrogallol, vanillic acid 등의 항산화 물질을 생합성 할 수 있다. P. putida의 p-hydroxybenzoate hydroxylase의 도입을 통해 gallic acid가 생산되었으며, Enterobacter cloacae의 PCA decarboxylase와 P. stutzeri OX1의 catechol hydrolase의 도입을 통해 PCA가 pyrogallol로 전환되는 연구가 이루어졌다 [11]. 이처럼 TPA로부터 다양한 고부가가치 산물을 만드는 미생물 균주 개발이 활발히 연구되고 있다.
폴리우레탄(PU)
플라스틱의 종류는 플라스틱 고분자를 만드는 단량체에 의해 결정되며, 각각의 단량체가 고분자로 중합되는 과정에서 다른 화학 결합이 형성된다. 에스터 결합만으로 연결된 PET와 달리 PU는 에스터 결합으로 연결되면 PES-PU, 에테르 결합으로 연결되면 PE-PU로 명명된다. 자연계의 효소들은 lipase, esterase, cutinase, protease, laccase 등과 같이 에스터 그룹을 가수분해하는 것에 더 유리하여 PU 분해 연구는 PES-PU 분해에 집중되어 있다. 최근에 발견된 PU를 탄소원으로 생장하는 P. chlororaphis 와 C. acidovorans TB-35에서 PU 분해에 결정적인 역할을 하는 esterase가 밝혀졌다 [12,13]. 이 esterase는 PU 고분자를 분해하여 분해 산물로 adipic acid, 1,4-butanediol, 2,4-toluenediamine, EG를 만들게 된다(그림 2).
분해 산물 중 하나인 adipic acid는 나일론을 합성하는 데 쓰이는 유용한 전구체이다. 여러 미생물 내부에도 adipic acid를 합성하거나 사용하는 다양한 경로가 있는데, Acinetobacter baylyi에서 유래한 dcaAKIJP operon은 adipyl-CoA transferase, dehydrogenase, adipic acid 흡수 단백질을 포함한다. dcaAKIJP operon을 P. putida KT2440의 genome에 삽입함과 동시에 PHA 생합성 경로를 강화하는 대사공학적 전략을 통해 adipic acid를 PHA로 전환하는 균주가 개발되었다 [14]. P. putida KT2440의 adipic acid 이용률을 높이기 위해서 점진적으로 고농도의 adipic acid 환경에서 균주를 배양하는 adaptive laboratory evolution (ALE) 기술이 적용되었다. ALE로 얻어진 균주의 유전 서열을 분석한 결과 phenylacetate 분해 경로에서 핵심적인 역할을 담당하는 paa 유전자가 강화된 것이 확인되었으며, 동시에 지방산 분해 경로인 β-oxidation 경로의 조절인자인 psrA 유전자의 약화를 통해 최종적으로 adipic acid를 잘 소모하면서 최대량의 PHA를 생산하는 P. putida KT2440 균주가 개발되었다(그림 3).
나일론의 단량체인 hexamethylenediamine (HMDA)을 adipic acid로부터 생산하는 연구도 주목을 받고 있다. 앞서 언급한 PHA 생산 경로는 P. putida에 내재하여 있지만, 자연계에서 adipic acid를 HMDA로 전환하는 생물은 없으므로 다양한 효소의 조합을 통해 새로운 화학 반응 경로를 구성해야만 한다. Mycolicibacterium smegmatis MC2 155로부터 유래한 carboxylic acid reductase와 Silicibacter pomeroyi로부터 유래한 transaminase를 E. coli에 도입하여 adipic acid의 양쪽 말단을 amine으로 전환하는 실험이 설계되었으며, 각각의 효소의 발현량은 플라스미드의 복제수와 프로모터의 세기로 정교하게 조정되었다. 각각의 효소는 NADPH를 이용하여 반응을 촉매하기 때문에 세포 내 높은 NADPH 농도를 요구했으며, transhydrogenase (sthA와 pntAB), 6-phosphate isomerase (pgi), 6-phosphofructokinase (pfkA)의 추가적인 결손을 통해 HMDA의 생산량을 높일 수 있었다(그림 3).
폴리스티렌(PS)
PS는 C-C 결합으로 이루어진 고분자이다. PS를 분해하는 생물은 비교적 최근에 발견되었는데, 한때 화제가 되었던 스티로폼을 먹는 밀웜이다. 밀웜의 장에서 PS를 분해하는 미생물 P. aeruginosa DSM 50071가 최초로 발견되었다 [15]. PS의 분해 산물을 분석한 결과 PS가 먼저 oxidase에 의해 산화되어 에스터 결합을 생성하고, 산화된 PS에 추가적인 esterase가 작용하는 것이 PS를 분해하는 데 필요한 핵심 메커니즘으로 추정되었다. 비슷한 시기에 발견된 또 다른 PS 분해 미생물인 A. johnsoniii JNU01의 유전 서열 분석을 통해 alkane-1-monooxygenase가 그 역할을 담당하는 효소로 확인되었다(그림 2) [16]. 이러한 발견에 힘입어, PS가 분해되었을 때 주요하게 생성되는 분해 산물인 styrene을 이용하여 유용한 화학 소재를 생산하고자 하는 대사공학적 연구도 활발히 이루어졌다.
Mandelic acid는 화장품과 의약품의 전구체로 널리 쓰이는 물질이다. Mandelic acid의 생산을 위해 styrene을 (S)-1-phenyl-1,2-ethanediol을 거쳐 (S)-mandelic acid로 전환하는 연구가 이루어졌다 [17]. Pseudomonas sp. VLB120에서 유래한 styrene monooxygenase와 Sphingomonas sp. HXN-200에서 유래한 epoxide hydrolase에 의해 styrene이 (S)-1-phenyl-1,2-ethanediol로 전환되었으며, 두 번째 반응은 P. putida GPo1에서 유래한 alcohol dehydrogenase와 phenylacetaldehyde dehydrogenase에 의해 이루어졌다. 4개의 외래 효소가 도입된 E. coli 균주는 2상 배양 시스템에서 배양되었으며, 최종적으로 styrene으로부터 20.7 g/L의 mandelic acid를 생산하는 데 성공하였다(그림 3).
폴리에틸렌/폴리프로필렌(PE/PP)
PET, PU, PS의 분해와 업사이클링에 대한 연구가 비교적 활발히 진행되어 왔음에도 불구하고 전체 플라스틱의 50% 이상을 차지하는 PE와 PP의 분해에 관한 연구는 거의 없다. 이것은 이 두 폴리머의 backbone 사슬이 C-C 및 C-H 결합으로만 구성되어 있어 견고한 구조적 안정성과 소수성 특성을 갖기 때문이다. 그러나 이러한 난해한 특성에도 불구하고 PE와 PP를 유일 탄소원으로 생장하는 미생물이 최근에 발견되었는데, B. thuringiensis JNU01 균주는 PE를 탄소원으로 배양했을 때 분해 산물로 C7-29 alkane, C9 alkene, C11 carboxylic acid, C6 alcohol 및 C11-15 ether를 생성하는 것을 확인하였다(그림 2) [18]. 이 균주의 전사체를 프로파일링하여 PE의 산화를 촉매하는 cytochrome P450의 과발현을 발견하였는데, 이는 PS의 경우와 같이 PE/PP의 C-C backbone을 분해하기 위해서는 가수분해가 가능한 작용기의 형성이 반드시 수반되어야 하며, PE와 PP 고분자가 산화된 이후에 cutinase, lipase, esterase 효소에 의해 더 짧은 carboxylic acid와 alcohol로 분해될 수 있다는 것을 말해준다 [19]. 다시 말해 C-C backbone에 산소의 비율을 높이는 것이 PE/PP 분해의 핵심으로 생각되는데, 이 과정을 폐기물 전처리 과정을 통해 진행하면 미생물에 의한 PE와 PP의 분해 효율을 많이 증가시킬 수 있다. 이에 주목하여 최근에는 PE/PP 플라스틱에 UV, 방사선 등의 물리적/화학적 기법을 도입하는 연구가 많이 진행되고 있다. 전처리를 통해 플라스틱 폐기물에 가수분해 가능한 작용기를 도입하고, 이를 미생물을 이용한 생물학적 기법으로 분해하는 전략이 현재 우리가 당면한 플라스틱 폐기물 문제를 해결하는 데 큰 도움을 줄 것으로 기대된다.
3. 결론
플라스틱은 저렴하면서도 뛰어난 물성을 가져 다양한 용도로 넓게 쓰이고 있지만, 플라스틱의 수명 주기는 환경 오염과 자원 고갈 문제를 야기하고 있다. 이러한 상황에서 바이오 업사이클링은 플라스틱 폐기물 위기를 해결하기 위한 유망한 대안으로 인정받고 있으며, 본 기고문에서는 플라스틱 생분해능이 있는 미생물과 이를 통해 생성된 분해물의 즉각적인 업사이클링을 통한 고부가가치 제품들을 소개하였다. 최근 프랑스의 녹색 화학 기업인 카바이오스가 컨소시엄을 형성하여 폐 PET를 분해 후 재활용하고 산업체에 공급하기까지의 대책을 제시하는 등의 예시에서 볼 수 있듯이 생물학적 기법을 이용한 폐플라스틱 재활용 산업은 빠르게 성장하고 있고, 여러 모범사례가 생겨나고 있다. 그러나 PE, PP, PVC, PU, PS와 같은 다른 주요 플라스틱은 현재까지 PET 분해 효소에 비견될 만한 높은 활성을 가진 분해 효소가 밝혀지지 않았으며, 이러한 근본적인 문제를 해결해야만 산업 수준의 효율성을 달성할 수 있다.
가장 먼저 원하는 화학물질 생산을 위해 플라스틱 폐기물의 효율적인 분해 및 바이오 업사이클링을 위해 신뢰할 수 있는 미생물을 선정해야 한다. 호스트 균주는 폐기물에 대한 충분한 내성을 가짐과 동시에 유용한 대사 경로를 보유했거나 효율적인 유전자 조작이 가능해야 한다. 유전자 정보, 대사 및 효소 데이터베이스의 발전으로, 선정된 균주의 고유대사 경로를 강화하거나 약화하고 새로운 이종 경로를 도입하는 것이 크게 촉진되었다. 이러한 대사공학적 접근은 통해 플라스틱 폐기물 분해 및 업사이클링의 효율성을 향상할 수 있을 뿐만 아니라 생산 표적 역시 다양하게 확장할 수 있다. 이외에도 ALE를 이용한 균주의 생산성 향상, 단백질 공학을 이용한 새로운 효소의 개발은 플라스틱 폐기물 분해 및 바이오 업사이클링의 효율성을 더욱 향상하는 강력한 전략이 될 수 있다. 또한, 최근 트렌드는 인공 지능을 통합하여 지시, 진화를 조종하여 원하는 특성을 갖는 단백질을 달성하는 데 필요한 실험 반복 횟수를 최소화한다. 이러한 전략들이 통합된 시스템 대사 공학에 의한 플라스틱 분해와 업사이클링이 플라스틱 폐기물 처리에 대한 근본적인 솔루션을 제공하리라 기대한다.
참고문헌
1. Geyer, R., Jambeck, J.R., and Law, K.L. (2017). Production, use, and fate of all plastics ever made. Science advances 3, e1700782.
2. Lomwongsopon, P., and Varrone, C. (2022). Critical review on the progress of plastic bioupcycling technology as a potential solution for sustainable plastic waste management. Polymers 14, 4996.
3. Lee, G.H., Kim, D.W., Jin, Y.H., Kim, S.M., Lim, E.S., Cha, M.J., Ko, J.K., Gong, G., Lee, S.M., and Um, Y. (2023). Biotechnological Plastic Degradation and Valorization Using Systems Metabolic Engineering. International Journal of Molecular Sciences 24, 15181.
4. Ragaert, K., Delva, L., and Van Geem, K. (2017). Mechanical and chemical recycling of solid plastic waste. Waste management 69, 24-58.
5. Rahimi, A., and García, J.M. (2017). Chemical recycling of waste plastics for new materials production. Nature Reviews Chemistry 1, 0046.
6. Kushwaha, A., Goswami, L., Singhvi, M., and Kim, B.S. (2023). Biodegradation of poly (ethylene terephthalate): Mechanistic insights, advances, and future innovative strategies. Chemical Engineering Journal 457, 141230.
7. Tournier, V., Topham, C., Gilles, A., David, B., Folgoas, C., Moya-Leclair, E., Kamionka, E., Desrousseaux, M.L., Texier, H., and Gavalda, S. (2020). An engineered PET depolymerase to break down and recycle plastic bottles. Nature 580, 216-219.
8. Li, A., Sheng, Y., Cui, H., Wang, M., Wu, L., Song, Y., Yang, R., Li, X., and Huang, H. (2023). Discovery and mechanismguided engineering of BHET hydrolases for improved PET recycling and upcycling. Nature Communications 14, 4169.
9. Franden, M.A., Jayakody, L.N., Li, W.J., Wagner, N.J., Cleveland, N.S., Michener, W.E., Hauer, B., Blank, L.M., Wierckx, N., and Klebensberger, J. (2018). Engineering Pseudomonas putida KT2440 for efficient ethylene glycol utilization. Metabolic engineering 48, 197-207.
10. Sasoh, M., Masai, E., Ishibashi, S., Hara, H., Kamimura, N., Miyauchi, K., and Fukuda, M. (2006). Characterization of the terephthalate degradation genes of Comamonas sp. strain E6. Applied and Environmental Microbiology 72, 1825-1832.
11. Tang, H., Wang, A., Salley, S.O., and Ng, K.S. (2008). The effect of natural and synthetic antioxidants on the oxidative stability of biodiesel. Journal of the American Oil Chemists' Society 85, 373-382.
12. Howard, G.T., Crother, B., and Vicknair, J. (2001). Cloning, nucleotide sequencing and characterization of a polyurethanase gene (pueB) from Pseudomonas chlororaphis. International biodeterioration & biodegradation 47, 141-149.
13. Nomura, N., Shigeno-Akutsu, Y., Nakajima-Kambe, T., and Nakahara, T. (1998). Cloning and sequence analysis of a polyurethane esterase of Comamonas acidovorans TB-35. Journal of Fermentation and Bioengineering 86, 339-345.
14. Wang, L., Li, G., Li, A., and Deng, Y. (2023). Directed Synthesis of Biobased 1, 6-Diaminohexane from Adipic Acid by Rational Regulation of a Functional Enzyme Cascade in Escherichia coli. ACS Sustainable Chemistry & Engineering 11, 6011-6020.
15. Kim, H.R., Lee, H.M., Yu, H.C., Jeon, E., Lee, S., Li, J., and Kim, D.-H. (2020). Biodegradation of polystyrene by Pseudomonas sp. isolated from the gut of superworms (larvae of Zophobas atratus). Environmental science & technology 54, 6987-6996.
16. Kim, H.W., Jo, J.H., Kim, Y.B., Le, T.K., Cho, C.W., Yun, C.H., Chi, W.S., and Yeom, S.J. (2021). Biodegradation of polystyrene by bacteria from the soil in common environments. Journal of Hazardous Materials 416, 126239.
17. Lukito, B.R., Sekar, B.S., Wu, S., and Li, Z. (2019). Whole cell‐based cascade biotransformation for the production of (S)‐mandelic acid from styrene, L‐phenylalanine, glucose, or glycerol. Advanced Synthesis & Catalysis 361, 3560-3568.
18. Yun, S.D., Lee, C.O., Kim, H.W., An, S.J., Kim, S., Seo, M.J., Park, C., Yun, C.H., Chi, W.S., and Yeom, S.J. (2023). Exploring a New Biocatalyst from Bacillus thuringiensis JNU01 for Polyethylene Biodegradation. Environmental Science & Technology Letters 10, 485-492.
19. Zhang, Y., Pedersen, J.N., Eser, B.E., and Guo, Z. (2022). Biodegradation of polyethylene and polystyrene: From microbial deterioration to enzyme discovery. Biotechnology Advances 60, 107991.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update