| 엑소좀을 활용한 차세대 의료 응용 분야의 연구 동향 | |
|---|---|
| Date 2024-05-02 15:15:21 |
|

책임연구원 / 박사후연구원
한국생명공학연구원 바이오나노연구센터
eklim1112@kribb.re.kr / ywjeong9104@kribb.re.kr
1. 서론
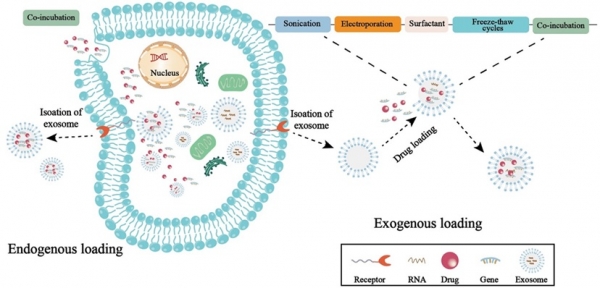
엑소좀(exosome)이란 일반적으로 30에서 150 nm 정도의 크기를 가지며 세포 내부로부터 원형질막의 발아(budding)를 통해 바깥쪽으로 방출되며 생성된다 (그림 1)[1]. 엑소좀은 일종의 세포로부터 유래된 세포 외 소포체로 내부에는 단백질, 지질과 같은 대사산물로부터 효소, 항체, 신호전달 물질 등의 다양한 기능성 분자와 mRNA와 같은 핵산 분자에 이르기까지 다양한 생체물질을 내포하고 있다. 방출된 엑소좀은 체액 내에서 표류하며 인근의 세포로 분화, 면역 등을 조절할 수 있는 신호전달 물질이나 단백질, 항체, 핵산 등을 옮기며 세포 간의 소통에도 관여한다. 이와 같은 기능성 물질들을 엑소좀의 인지질 막으로 보호를 받고 있기에 생체 내에서 효소에 의한 분해나 면역체계로부터 회피가 가능하여 장시간 안정적으로 운반될 수 있다. 이러한 높은 생체적합성과 생체 내에서의 안정성으로 인해 엑소좀을 이용한 약물과치료제의 전달, 세포의 이미지화, 조직 재생유도 등의 연구가 활발히 진행되고 있다 (그림 2)[2]. 또한 암 등의 질병이 발병되었을 때 특이적으로 발현되는 단백질이나 핵산을 담지하고 있는 엑소좀을 바이오마커(Biomarker)로 하여 질병의 조기진단에 관한 연구도 이루어지고 있다. 본 기고문에서는 엑소좀을 활용한 다양한 연구 중에서 질병 진단의 바이오마커로서의 그리고 약물 전달체로서의 최신 연구동향을 살펴보고자 한다.
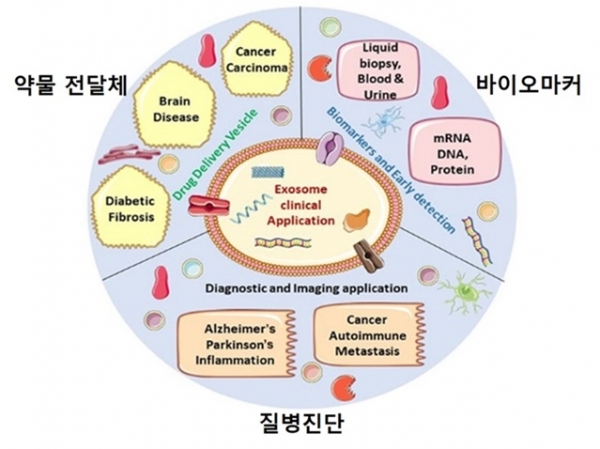
그림 2. 엑소좀을 활용한 다양한 연구 분야 도식 [2].
2. 본론
2.1. 엑소좀 연구의 중요성
엑소좀은 모세포에서 방출되어 다른 세포의 수용체와 상호작용을 하거나 자가 분비(autocrine), 측분비(paracrine), 내분비(endocrine)의 방식으로 기능성 물질과 신호를 전달하거나 전사를 조절 또는 다른 세포로 유용 물질을 전달해 치료효과를 발휘한다 [3]. 또한 인지질막으로 구성되어 있는 엑소좀은 높은 생체적합성을 가지며 생체 내에서 안정적으로 체류하며 유용 물질을 전달할 수 있어 약물이나 치료제의 전달체로 주목받고 있다. 엑소좀의 크기는 매우 작아 뇌혈관 장벽(Brain-blood barrier, BBB)을 관통하여 약물을 전달할 수 있다는 사실도 보고되어 뇌 관련 질환에 대한 약물 전달체로의 연구도 진행되고 있다 [4].
약물과 치료제 전달 기능뿐만 아니라, 이를 활용한 피부 미용 화장품에 대한 연구도 이루어지고 있다. 엑소좀의 크기는 모공보다 작으며, 인지질막 구조로 인해 내부의 기능성 물질을 파괴 없이 피부 안쪽까지 전달할 수 있다 [5]. 예를 들어 중간엽줄기세포(Mesenchymal stem cell, MSC)로부터 방출된 엑소좀은 혈관신생과 재생, 항염증 효과에 관여하는 물질들을 포함하고 있어 피부에 적용하였을 때 피부가 젊어지는 효과가 확인되기도 한다 [6]. 따라서 피부 미용업계에서도 엑소좀을 화장품 원료로 활용하는 연구가 많이 이루어지고 있다.
기존의 암 진단 기법은 수술 또는 바늘을 이용해 종양의 표본 조직을 절제하거나 추출하는 침습적인 방법을 이용한다. 본 방법은 환자에게 통증을 동반하고 국부적인 부위만 검사하기 때문에 종양에 대한 구체적인 정보를 얻기엔 제한적이며, 또한 회복 기간이 필요하여 주기적으로 시료를 얻기가 어려워, 이로 인해 암의 진행이나 항암 치료 효과를 실시간으로 모니터링 하기에 부적합하다.
최근 종양과 같은 질병을 진단하는 데 있어 침습적인 방법을 대체하기 위해 비침습적인 방법으로 땀, 눈물, 혈액 등의 체액을 분석하는 액체 생검(Liquid biopsy)이 이용되고 있다. 대표적으로 혈액 내에는 순환종양세포(Circulating tumor cell; CTC), 순환종양핵산(Circulating tumor Nucleic acid; ctNA)이나 엑소좀 (exosome)과 같은 성분들이 존재한다 [7]. 액체 생검을 통해 이러한 성분을 혈액 검사만으로 검출함으로써 질병을 조기에 진단할 수 있다. 그러나, CTC는 혈액 내에서 1~3 cell/mL의 매우 낮은 농도로 존재하고, ctNA는 외부적인 요인에 의해 분해되기 쉬워, 결과의 정확도에 영향을 줄 수 있다 [8]. 엑소좀은 모세포의 단백질 발현, 유전 정보 등의 특성을 가지고 배출되기 때문에, 엑소좀의 단백질이나 핵산의 발현 수준을 측정하는 것으로 모세포의 상태를 대변할 수 있어 질병의 발생 및 진행 단계, 치료 효과 등을 모니터링할 수 있다. 또한 인지질 막으로 구성된 엑소좀은 CTC와 달리 체액 내에 대량으로 존재하며, ctNA와 달리 안정적으로 체액 내를 순환할 수 있어 다양한 질병을 연구할 수 있는 바이오마커로 큰 관심을 받고 있으며, 이와 관련된 연구가 활발하게 진행되고 있다 [2].
2.2. 엑소좀 활용 질병 진단 기술 연구
엑소좀을 감싸고 있는 막은 당단백질이나 콜레스테롤, 그리고 막관통 단백질 등의 생체 표지분자를 가지고 있으며 표지된 생체분자들의 발현 패턴은 모세포와 유사하다고 보고된다 (그림 1)[1]. 대표적으로, 특정 유방암 세포에서 과발현되는 것으로 알려진 HER2 단백질이 그 세포에서 배출된 엑소좀에서도 과발현되어 있음이 확인된다. 또한, 엑소좀에 발현된 HER2 단백질을 진단 마커로 활용하여 암을 진단한 기술도 보고되었다 [9]. 엑소좀 유전자 또한 모세포와 유사한 패턴을 가지고 있어 모세포를 대변하여 다양한 질병을 전달할 수 있는 조기 진단용 유전자 마커로 활용될 수 있다. 엑소좀 유전자 발현 분석을 통해서도 전립선암, 유방암, 위암 등의 종양을 정밀 진단하는 기술이 보고된다 [10]. 엑소좀 단백질과 엑소좀 유전자를 활용한 진단 연구에 대한 구체적인 예시는 다음절에 기술하였다.
2.2.1. 엑소좀 단백질 마커 활용 연구
엑소좀은 혈액 내에 1 mL당 10억 개 이상으로 풍부하게 존재하지만, 특정 질병과 관련된 단백질 마커를 포함하고 있는 엑소좀의 양은 상대적으로 적다. 예를 들어 HER2 과발현 암 환자에게서 HER2가 과발현된 엑소좀은 1000개 내외로 존재하여, 엑소좀을 활용한 질병의 진단을 위해서는 고순도의 엑소좀 농축과 분리 검출 기술이 필요하다.
표적 단백질 마커를 가지고 있는 엑소좀을 포집하기 위해 항체(antibody)를 많이 활용한다. 특정 엑소좀을 분리하기 위해 미세 유체 칩(Microfluidic device)을 플랫폼으로 단백질 마커인 CD63을 표적으로 Anti-CD63을 이용한 연구가 보고되었고, 그 결과 소세포폐암 환자의 세럼(serum) 400 μL로부터 CD63을 약 30 ng 정도 분리할 수 있었다 [11]. 면역친화도(Immune affinity)의 원리를 이용하여 최대 12개까지 개수를 조절할 수 있는 챔버를 제작해 항원-항체반응으로 엑소좀을 포집한 다음 형광물질(DiO)을 표지(labeling)하여 플레이트 리더기로 각 챔버 속에서 분리된 엑소좀을 정량화한다. 본 방법은 췌장암 환자와 정상인을 비교하였을 때 췌장암 환자에게서 분리된 엑소좀의 양이 약 2.34배 많아 질병진단의 마커로 활용 가능성을 보여주었다.
항체로 기능화된 실리카 나노입자를 물고기의 뼈 모양(herring bone structure)으로 적층하여 유체의 혼합을 유도하는 동시에 항체와 표적 엑소좀의 접촉과 상호작용을 증가시켜 질병을 진단하는 연구도 보고되었다 (그림 3)[12]. 유방암 모델 쥐의 소변으로부터 유방암의 바이오마커인 HER2를 높은 효율로 포집할 수 있음을 보여주었다. 표면이 항체로 기능화 되어있는 자성입자를 이용하여 엑소좀을 포집하고, 자석을 이용하여 엑소좀을 고순도로 분리/농축 하는 방법도 보고되었다 [13]. 미세 유체 칩 내부를 전극 소재와 항체로 기능화하여 표적하는 엑소좀을 포집하고 전압을 걸어 탈리하여 고농도의 엑소좀 농축액을 얻는 방법 또한 보고 되었다 [14]. 엑소좀 외부 단백질 뿐만 아니라 내부 단백질도 바이오마커로 활용하여 표적 질병을 진단할 수 있다. 항체로 기능화된 자성입자를 혈장에 섞어 엑소좀을 선택적으로 분리한 후, 엑소좀을 용해하여 내부에 있던 단백질을 해리시킨다. 이어서, 해당 단백질을 포집할 수 있는 다른 자성입자와 결합시킨 후 형광 물질을 사용하여 목표로 하는 단백질을 검출함으로써 질병을 진단하게 된다. 이 방법은 최소 30μL의 혈장을 100분 이내에 분석할 수 있다 [15]. 항체와 마찬가지로 압타머(Aptamer)를 자성입자나 고체 표면 등에 고정하여 표적 엑소좀을 검출하는 방법도 보고되고 있다. 엑소좀의 안정적인 포집을 위해 자성 나노 입자에 스트렙타비딘(streptavidin)을 코팅하고 상보적으로 결합할 수 있는 바이오틴(biotin)이 도입된 anti-CD63 압타머를 이용하는 방식이다 [16].
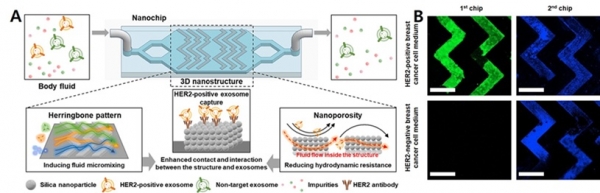
그림 3. 엑소좀 단백질 마커 진단 연구. A: 엑소좀 단백질 마커 포집 기술 개념도 및 B: 결과 [12].
2.2.2. 엑소좀 유전자 마커 활용 연구
유전자 마커는 우리 몸의 다양한 정보를 담고 있으며, 질병 등의 변화를 알아낼 수 있는 지표로서, 동일한 암 종임에도 특성, 발생 단계에 따라 다양한 유전자가 발현하게 된다. 이는 엑소좀 유전자 발현 분석을 통해 정확한 암 진단, 예후 및 치료 모니터링에 있어 비침습성 바이오마커로서의 가능성을 증명한다. 엑소좀 유전자와 엑소좀 단백질을 함께 분석하면 다양한 질병을 진단하고 예후의 판별이 가능하다. 대표적으로 특정 유전자를 증폭하는 중합효소 연쇄반응(polymerase chain reaction, PCR) 기술이 있다. 최근에는 차세대 염기서열 분석(NGS) 기술과 디지털 PCR기술 등 검출·분석 방법의 급격한 발전으로 체액 내 극미량으로 존재하는 유전자 분석이 가능해지고 있다.
그러나, 이러한 기술들은 전처리 과정, 효소 사용과 고가의 분석 장비 등이 필요하기 때문에 최근에는 보다 효율적이며 간단한 방법으로 유전자 검출 신호를 증폭하는 연구가 이루어지고 있다. 엑소좀유래 유전자와 상보적인 결합이 가능한 유전자 서열이 포함된 단일 가닥의 RNA 형태인 분자 비콘 (molecular beacon)을 개발하였다, 특히, 형광 공명 에너지 전이(Fluorescence resonance energy transfer, FRET) 현상을 활용하여 대상 엑소좀 유전자의 검출 여부를 형광 신호 발생으로 확인하고자, 분자 비콘은 한쪽 말단에는 형광단을, 반대쪽 말단에는 소광(Quencher)단을 표지하고, 헤어핀(Hair pin) 구조로 결합할 수 있도록 양쪽 말단의 유전자 서열을 제작하였다. 표적으로 하는 엑소좀 유전자 존재 시 결합된 가닥이 풀어지며 형광 신호가 발생되어 표적 유전자 검출 여부를 형광 신호로 확인하게 된다 [17]. 특정 DNA 또는 RNA를 타겟으로 하여 복잡한 샘플 속에서도 극미량의 유전자를 높은 특이성과 민감성으로 검출할 수 있도록 Catalytic Hairpin Assembly(CHA)를 이용한 검출 기술도 보고되고 있다 [18]. CHA 반응은 두 종류의 헤어핀 구조의 올리고뉴클레오티드를 사용하지만, 이들은 타겟 유전자의 촉매 작용에 의해 순차적으로 상호작용하고 조립된다. 타겟 유전자는 두헤어핀 구조가 조립되는 과정을 촉매화하여 반복적인 신호 증폭을 유도한다. 이 과정을 통해 신호가 증폭되어 높은 민감도와 특이성을 제공한다. CHA 방법을 활용하여 유방암의 유전자 마커인 HER2 mRNA와 항존 유전자인 GAPDH mRNA를 동시에 검출하였다 (그림 4)[18]. 표적 유전자와 결합시 형광 신호가 증폭될 수 있는 CHA 프로브를 설계하여 이를 리포솜에 담지하여 하이드로겔 구조체에 고정하였고, 표적 유전자가 담지되어 있는 엑소좀을 결합하면 형광신호가 증폭되는 방식으로 표적 유전자와 항존유전자를 동시에 분석하도록 설계되었고, 시료의 정보를 보다 정밀한 분석이 가능하였다.
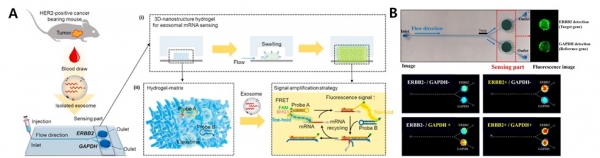
그림 4. 엑소좀 유전자 마커 진단 연구. A: 유방암 유래 엑소좀 HER2 유전자 진단칩 개념도 및 B: 검출 결과 [18].
혈액을 이용하여 알츠하이머 병을 진단하고자 알츠하이머 병 환자 혈액 내 엑소좀 유전자 마커인 miR-574-5p를 검출가능한 CHA프로브 담지 하이드로겔 구조체를 개발하여 1.29 pM 수준까지 검출하였으며, 실제 알츠하이머 병 환자의 혈액을 이용하여 알츠하이머 병의 진단 가능성을 확인하였다 (그림 5)[19].

그림 5. 엑소좀 유전자 마커 진단 연구. A: CHA 반응 기반 알츠하이머 병 진단 기술 개념도 및 B: 결과 [19].
효소를 사용하지 않고 온도 변화 없이 실온 조건에서 엑소좀 유전자 마커를 검출하는 방법 중 하나로 Fuel stimulated powered amplification(FSP)기법도 있다 [20]. FSP는 연료(Fuel) 역할을 하는 올리고뉴클레오티드가 포함되어 있어 검출 신호를 증폭해주는 기술이다. 그림 6에서 보이는 바와 같이 타겟 유전자와 특이적으로 결합할 수 있는 서열을 포함한 올리고뉴클레오티드 (Oligo-A)와 상보적으로 결합하면서 형광체와 소광체가 결합된 올리코뉴클레오티드(Oligo-B와 Oligo-C)를 사용한다. 타겟 유전자가 없을 때는 FRET반응에 의하여 형광 신호가 나타나지 않으나 타겟 유전자가 검출되면 소광체가 결합된 Oligo-B가 이격되면서 형광 신호가 발생하게 된다. 연료로 작용하는 올리고뉴틀레오티드를 추가하면, 타겟 유전자와 형광체가 결합된 Oligo-C가 이격되고 FSP반응이 순환되면서 형광 신호가 증폭된다. 이 반응은 타겟 유전자의 재사용을 가능하게 하여, 극소량의 타겟을 고감도로 검출 할 수 있다 (그림 6)[20]. 최근 FSP 기법을 활용하여 위암 환자 혈액 내 존재하는 2종의 엑소좀 유전자(miRNA)를 검출하였다 [20].
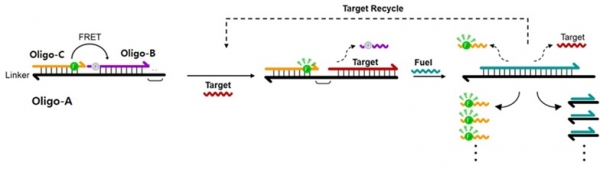
그림 6. FSP기법을 활용한 엑소좀 유전자(Target) 검출 방법의 개념도 [20].
2.3. 엑소좀 활용 치료 기술 연구
약물 전달의 주요 방법 중 하나는 난용성 약물을 지질 기반 입자에 담지하여 체내로 전달하는 것이다. 이를 통해 병변 조직에 약물을 집중적으로 전달하여 질병을 치료하고자 한다. 그런데, 대부분의 약물은 혈류를 따라 이동하다가 면역체계에 의하여 제거되거나 표적 병변이 아닌 다른 부위로 전달되어 약물이 소실되는 경향이 있다. 세포에서 분비되는 엑소좀은 세포막의 성분과 동일한 인지질 이중막으로 구성되어 있어 생체 내에서 안정적이며 긴 반감기를 가지고 있다 [21]. 또한 크기도 30 ~ 150 nm 로 매우 작아 혈액 뇌장벽(Blood-Brain Barrier, BBB)과 같은 장막을 쉽게 통과할 수 있다. 예를 들어 중추신경 질환에 대한 치료제는 BBB를 통과하여 약물을 뇌 조직으로 전달되어야 하지만 대부분 BBB를 통과하지 못할뿐더러 통과하더라도 단핵구에 의해 쉽게 제거된다. 하지만 엑소좀의 경우 BBB 통과가 가능하며 면역체계로부터 회피하여 목적한 병변으로 약물을 전달할 수 있다고 알려져 있다. 또한, 엑소좀의 표면에는 면역 조절인자, 막 수송 단백질, 테트라스파닌(tetraspanin) 등의 단백질이 표지되어 있어 [22], 엑소좀이 세포 내로 들어가 신호물질을 전달하거나 세포의 융합을 통한 내재화로 엑소좀이 내포하고 있던 단백질, 지질, 핵산 분자 등을 수송하는 역할을 할 수 있으며, 이에 따라 약물의 전달 과정에서 방출되어 소실되는 약물을 최소화할 수 있다. 이런 특징으로 엑소좀을 이용한 표적 약물 전달시스템에 대한 연구가 활발히 이루어지고 있다 [23].
Mesenchymal stem cells (MSCs)로부터 유래된 엑소좀에 내포되어 있는 miR-223은 PTEN-PI3K/Akt 신호 전달 체계를 통해 세포 사멸신호로부터 신경세포를 보호하여 알츠하이머병의 진행을 억제할 수 있다고 알려져 있다 [24]. 또한 골수 MSC 유래 엑소좀의 miR-206은 골육종(osteosarcoma)의 증식과 전이가 억제됨이 확인되었다 [25].
유용물질 자체가 내포되어 있는 엑소좀을 이용하는 방법 외에도 엑소좀에 치료제를 담지하여 약물 전달체로 활용하는 연구도 활발히 이루어지고 있다. 엑소좀 내부로 약물을 담지하는 기법은 유전자 조작을 통한 형질 감염(Transfection), 전기 천공법(Electroporation), 초음파처리, 투석법 등이 있다 [21].
우유로부터 유래된 엑소좀은 경구로 투여했을 때 위장의 산성조건 내에서 내포된 물질을 안정적으로 보존하여 위 상피세포에 흡수가 잘 된다고 알려져 있다 [26]. 우유 유래 엑소좀에 위타페린 A (Withaferin A), 파크리탁셀 (Paclitaxel), 도세탁셀 (Docetaxel) 등의 항암제를 담지하여 투여한 결과, 단독으로 항암제만을 사용했을 때 보다 암세포 사멸 효과가 더 높은 것으로 확인되었다 [27].
형질감염을 통하여 MSC에 유방암의 단백질 마커인 HER2와 특이적으로 결합할 수 있는 안카린 반복 단백질(Ankyrin repeat protein, DARP)의 발현을 유도하여, MSC가 DARP가 표지된 엑소좀을 생성하도록 하였다 [28]. 이렇게 생성된 DARP표지 엑소좀에 Doxorubicin(DOX)를 담지하여 유방암을 표적하여 약물을 처리한 결과 높은 사멸 효과를 확인할 수 있었다. 같은 방법으로 MSC에 대장암 세포 표면에서 발현되는 Mucin 1 수용체와 결합가능한 5TR1 압타머를 발현시킨 후, 5TR1 압타머-엑소좀에 DOX를 전달하는 연구도 보고되었다 [29]. 재조합 단백질이나 백신 생산에 흔히 사용되는 인간배아신장세포(Human Embryonic Kidney 293 cell, HEK293)에 형질감염으로 특정 병변과 특이적으로 결합하는 단백질을 발현시킨 후, 확보한 엑소좀을 이용하여 목표한 병변에 효과적으로 운반할 수 있음이 확인되었다 [30,31]. 이처럼 엑소좀을 활용한 치료법은 체내에서 안정적으로 순환하고 효율적으로 표적 병변에 약물을 전달할 수 있는 뛰어난 장점을 제공한다.
3. 결론
엑소좀을 활용한 최신 의료 연구는 질병의 조기 진단, 정밀한 모니터링, 그리고 표적화된 약물 전달을 가능하게 하는 혁신적인 방법을 제시한다. 이들은 생체 내에서 안정적이며 특정 조직이나 병변으로 약물을 직접 전달할 수 있는 능력을 지니고 있어, 치료 효과를 극대화하고 부작용을 최소화할 수 있는 뛰어난 잠재력을 가진다. 그러므로 엑소좀을 활용한 기술은 향후 의학 분야에서 중요한 역할을 할 것으로 예상된다.
참고 문헌
1. Jeppesen, D. K., Zhang, Q., Franklin, J. L., & Coffey, R. J. (2023). Extracellular vesicles and nanoparticles: Emerging complexities. Trends in Cell Biology.
2. Huda, M. N., Nafiujjaman, M., Deaguero, I. G., Okonkwo, J., Hill, M. L., Kim, T., & Nurunnabi, M. (2021). Potential use of exosomes as diagnostic biomarkers and in targeted drug delivery: progress in clinical and preclinical applications. ACS Biomaterials Science & Engineering, 7(6), 2106-2149.
3. Maia, J., Caja, S., Strano Moraes, M. C., Couto, N., & Costa-Silva, B. (2018). Exosome-based cell-cell communication in the tumor microenvironment. Frontiers in cell and developmental biology, 6, 18.
4. Ramos-Zaldívar, H. M., Polakovicova, I., Salas-Huenuleo, E., Corvalán, A. H., Kogan, M. J., Yefi, C. P., & Andia, M. E. (2022). Extracellular vesicles through the blood–brain barrier: A review. Fluids and Barriers of the CNS, 19(1), 1-15.
5. Olumesi, K. R., & Goldberg, D. J. (2023). A review of exosomes and their application in cutaneous medical aesthetics. Journal of Cosmetic Dermatology, 22(10), 2628-2634.
6. Yin, L., Liu, X., Shi, Y., Ocansey, D. K. W., Hu, Y., Li, X., ... & Qian, H. (2020). Therapeutic advances of stem cell-derived extracellular vesicles in regenerative medicine. Cells, 9(3), 707.
7. Das, J., & Kelley, S. O. (2020). High-performance nucleic acid sensors for liquid biopsy applications. Angewandte Chemie, 132(7), 2574-2584.
8. Hoshino, A., Kim, H. S., Bojmar, L., Gyan, K. E., Cioffi, M., Hernandez, J., ... & Lyden, D. (2020). Extracellular vesicle and particle biomarkers define multiple human cancers. Cell, 182(4), 1044-1061.
9. Lim, J., Kang, B., Son, H. Y., Mun, B., Huh, Y. M., Rho, H. W., ... & Lim, E. K. (2022). Microfluidic device for one-step detection of breast cancer-derived exosomal mRNA in blood using signal-amplifiable 3D nanostructure. Biosensors and Bioelectronics, 197, 113753.
10. Li, B., Cao, Y., Sun, M., & Feng, H. (2021). Expression, regulation, and function of exosome-derived miRNAs in cancer progression and therapy. The FASEB Journal, 35(10), e21916.
11. Kanwar, S. S., Dunlay, C. J., Simeone, D. M., & Nagrath, S. (2014). Microfluidic device (ExoChip) for on-chip isolation, quantification and characterization of circulating exosomes. Lab on a Chip, 14(11), 1891-1900
12. Mun, B., Jeong, H., Kim, R., Gu, B., Kim, J., Son, H. Y., ... & Haam, S. (2024). 3D-Nanostructured microfluidic device arranged in a herringbone pattern for the highly effective capture of HER2-Positive cancer-derived exosomes in urine. Chemical Engineering Journal, 148851.
13. Yang, W., Yu, Y., Shou, X., Zhang, D., Liang, G., & Zhao, Y. (2021). Hedgehog-inspired magnetic nanoparticles for effectively capturing and detecting exosomes. NPG Asia Materials, 13(1), 78.
14. Lin, S., Yu, Z., Chen, D., Wang, Z., Miao, J., Li, Q., ... & Cui, D. (2020). Progress in microfluidics-based exosome separation and detection technologies for diagnostic applications. Small, 16(9), 1903916.
15. Krivitsky, V., Krivitsky, A., Mantella, V., Ben-Yehuda Greenwald, M., Sankar, D. S., Betschmann, J., ... & Leroux, J. C. (2023). Ultrafast and Controlled Capturing, Loading, and Release of Extracellular Vesicles by a Portable Microstructured Electrochemical Fluidic Device. Advanced Materials, 35(44), 2212000.
16. Zhang, K., Yue, Y., Wu, S., Liu, W., Shi, J., & Zhang, Z. (2019). Rapid capture and nondestructive release of extracellular vesicles using aptamer-based magnetic isolation. ACS sensors, 4(5), 1245-1251.
17. Lee, J. H., Kim, J. A., Kwon, M. H., Kang, J. Y., & Rhee, W. J. (2015). In situ single step detection of exosome microRNA using molecular beacon. Biomaterials, 54, 116-125.
18. Lim, J., Kang, B., Son, H. Y., Mun, B., Huh, Y. M., Rho, H. W., ... & Lim, E. K. (2022). Microfluidic device for one-step detection of breast cancer-derived exosomal mRNA in blood using signal-amplifiable 3D nanostructure. Biosensors and Bioelectronics, 197, 113753.
19. Lim, J., Kim, S., Oh, S. J., Han, S. M., Moon, S. Y., Kang, B., ... & Lim, E. K. (2022). miRNA sensing hydrogels capable of self-signal amplification for early diagnosis of Alzheimer's disease. Biosensors and Bioelectronics, 209, 114279.
20. Lim, J., Hwang, J. S., Seo, S. B., Kang, B., Jang, S., Son, S. U., ... & Lim, E. K. (2022). Janus hydrogel-based fuel stimulant powered amplification for multiple detections of miRNA biomarkers in gastric cancer. Chemical Engineering Journal, 448, 137637.
21. Huang, L., Wu, E., Liao, J., Wei, Z., Wang, J., & Chen, Z. (2023). Research Advances of Engineered Exosomes as Drug Delivery Carrier. ACS omega, 8(46), 43374-43387.
22. Ravasco, J. M., Paiva-Santos, A. C., & Conde, J. (2023). Technological challenges of biomembrane-coated top-down cancer nanotherapy. Nature Reviews Bioengineering, 1(3), 156-158.
23. Chen, L., Wang, L., Zhu, L., Xu, Z., Liu, Y., Li, Z., ... & Luo, F. (2022). Exosomes as drug carriers in anti-cancer therapy. Frontiers in Cell and Developmental Biology, 10, 728616.
24. Wei, H., Xu, Y., Chen, Q., Chen, H., Zhu, X., & Li, Y. (2020). Mesenchymal stem cell-derived exosomal miR-223 regulates neuronal cell apoptosis. Cell death & disease, 11(4), 290.
25. Zhang, H., Wang, J., Ren, T., Huang, Y., Liang, X., Yu, Y., ... & Guo, W. (2020). Bone marrow mesenchymal stem cellderived exosomal miR-206 inhibits osteosarcoma progression by targeting TRA2B. Cancer letters, 490, 54-65.
26. Betker, J. L., Angle, B. M., Graner, M. W., & Anchordoquy, T. J. (2019). The potential of exosomes from cow milk for oral delivery. Journal of pharmaceutical sciences, 108(4), 1496-1505.
27. Munagala, R., Aqil, F., Jeyabalan, J., & Gupta, R. C. (2016). Bovine milk-derived exosomes for drug delivery. Cancer letters, 371(1), 48-61.
28. Gomari, H., Forouzandeh Moghadam, M., & Soleimani, M. (2018). Targeted cancer therapy using engineered exosome as a natural drug delivery vehicle. OncoTargets and therapy, 5753-5762.
29. Bagheri, E., Abnous, K., Farzad, S. A., Taghdisi, S. M., Ramezani, M., & Alibolandi, M. (2020). Targeted doxorubicinloaded mesenchymal stem cells-derived exosomes as a versatile platform for fighting against colorectal cancer. Life Sciences, 261, 118369.
30. Limoni, S. K., Moghadam, M. F., Moazzeni, S. M., Gomari, H., & Salimi, F. (2019). Engineered exosomes for targeted transfer of siRNA to HER2 positive breast cancer cells. Applied biochemistry and biotechnology, 187, 352-364.
31. Zou, J., Shi, M., Liu, X., Jin, C., Xing, X., Qiu, L., & Tan, W. (2019). Aptamer-functionalized exosomes: elucidating the cellular uptake mechanism and the potential for cancer-targeted chemotherapy. Analytical chemistry, 91(3), 2425-2430.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update